Há algumas reações químicas que estão entre o conteúdos que mais caem no ENEM, dentre elas se encontram a equação química de produção do alumínio a partir da bauxita e alumina e a de reciclagem de baterias, atividade realizada para evitar que metais pesados intoxiquem o meio ambiente.
Produção de baterias no Brasil e o lixo eletrônico
Por ano, no Brasil, eram fabricadas, em média, nos anos 2000, 800 milhões de pilhas comuns e alcalinas. O que tem um enorme impacto na natureza. Além disso, a situação é ainda mais grave quando se consideram as baterias que compõem o celular. Ao todo, 1,2 bilhão de pilhas circulavam todos os anos no país na referida década, contudo, 400 milhões eram contrabandeadas, não apresentando nenhuma garantia de que seguiam as normas e padrões de segurança definidos pelos órgãos competentes, aumentando, assim, o risco de poluição causada pelos objetos descartados de maneira errônea.
As pilhas e baterias deveriam ser descartadas em aterros sanitários, logo após terem sido tratadas químicamente para inutilizar sua parte tóxica. Todavia, a grande maioria das cidades brasileiras não possuem aterros, descartando, então, as pilhas e baterias em locais inapropriados, como lixões ou vazadouros clandestinos.
Como pilhas e baterias são recicladas
Este pequeno vídeo mostra alguns detalhes empresariais sobre a reciclagem de pilhas e baterias, como preços e necessidades para o barateamento do processo de reciclagem de pilhas e baterias, bem como os números relacionados aos seus impactos sociais.
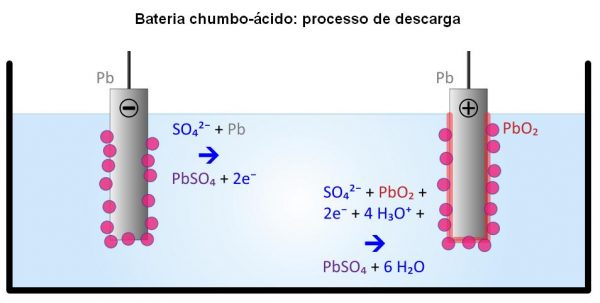
Reação eletroquímica das baterias de chumbo
Composição química da baterias automotivas esgotadas
Geralmente, a média de uma bateria automotiva esgotada é de, aproximadamente, 2% Pb, 3% PbO, 17% PbO2 e 36% PbSO4, mas sobra uma pasta base residual, que tem em torno de 6 kg e é composta por 19% é PbO2, 60% PbSO4 e 21% Pb. Dentre esses compostos, o mais preocupante é o sulfato de chumbo (II), pois nos processos pirometalúrgicos, em que os compostos de chumbo (placas das baterias) são fundidos, há a conversão do sulfato em dióxido de enxofre, gás muito poluente.
Processo químico da reciclagem das baterias automotivas
Dessulfuração
Para evitar danos ao meio ambiente por causa das emissões do SO2, durante o processo de reciclagem das baterias automotivas, as indústrias utilizam um processo hidrometalúrgico para a dessulfuração antes que o composto de chumbo seja fundido. Para isso, após ser triturado, o composto de chumbo sofre lixiviação com o carbonato de sódio (Na2CO3) 1M a 45°C, obtendo-se, assim, carbonato de chumbo (II) com rendimento de 91%. Depois desse processo, o material resultante segue para a fundição onde se obtém o chumbo metálico.
Questões do ENEM sobre reciclagem de baterias
ENEM 2010 – Química
Como a pilha de zinco é fabricada?
Com toda essa informação sobre como reciclar pilhas e baterias, obviamente, começa-se, também, a indagar como a pilha é fabricada. No caso da pilha de zinco, o manganês representará o polo positivo, e o zinco, por ter menor potencial de redução, será o pólo negativo, representando, na situação de reação espontânea, o ânodo e será oxidado. Quando não houver mais o que oxidar, é porque todo o zinco em pó disponível na pilha já terá seu nox aumentado ao máximo, ou seja, não restará mais nada a ser oxidado para garantir a diferença de potencial necessária para acontecer a conrrente elétrica por meio da voltagem que até então provocava o fenômeno da movimentação de elétrons, produzindo, conseguentemente eletricidade.
O fundo da pilha será a parte negativa, pois o metal estará em contato com o zinco em pó que se encontra no interior, já a o topo, será a parte positiva, feita de manganês. A diferença de voltagem obtida por meio destes dois elementos, na pilha tradicional, é de 1,5 V.
Através do próximo vídeo em destaque, é possível saber como funciona uma fábrica de pilhas e baterias, ressaltando os processos de fabricação da pilha, bem como os meios pelos quais é garantida a qualidade do processo de produção das pilhas de zinco, ou, em termos mais acertivos, pilhas de manganês, cobre e zinco. Todavia, existem, atualmente, pilha feitas com outros materiais, como as de lítio ou níquel, ou que contêm alguns que são proibidos em grandes quantidades, como o chumbo. No caso de um coletor que recebe direferentes tipos de pilha a serem moídas ao mesmo tempo, o processo de separação dos metais que as compõem é realizado quando estão na fase líquida.
O vídeo também mostrará alguns produtos que podem ser obtidos através da reciclagem de baterias e pilhas.
Como o alumínio é produzido?
Já que falamos da reciclagem das baterias como uma das matérias que mais caem no ENEM, em termos de equação química, porque não falar, também da produção de alumínio?
A produção de alumínio se dá com a extração da bauxita, que contém óxido de alumínio hidratado, também chamado de alumina. Este composto é obtido por meio da fragmentação da própria bauxita, pois ele se encontra na argila que a compõe. Nessa etapa, não há, portanto, reação química envolvida no processo. Contudo, a partir da alumina, que pontém dois átomos de alumínio e três de oxigênio, é preciso remover o último, e isso é feito através da eletrólise.
Eletrólise da Alumina
Já com a molécula de alumina “em mãos” é chegada a hora de separar seus íons e obter alumínio em sua forma metálica, redurindo-o de Al3+ para Al0. Como este não é um procedimento de fácil obtenção de forma espontânea de acordo com as condições ambientais do planeta terra, é preciso gastar energia, ou seja, o processo se dará por meio da eletrólise. Como o alumínio será reduzido, obviamente isso acontecerá no cátodo. Já o oxigênio sofrerá oxidação no ânodo, onde junto ao eletrodo de carbono, que não se enquadra como eletrodo inerte por particrpar da oxidação, formará o gás carbônico (C02).
2Al2O3 + C -> 4Al0 + 3CO2
Reação que ocorre no cátodo: 2Al23+ -> 4Al0
Reação que ocorre no ânodo: 2O32- + C0 -> 3CO2
Obs.: É sempre bom lembrar que, na eletrólise, ao contrário da pilha, o cátodo é o polo negativo e o ânodo o positivo. Pois os elétrons se movimentam num fluxo contrário ao provocado por uma reação espontânea.
Patrocinadores dessa aula sobre reciclagem de pilhas
Para essa aula sobre reciclagem de pilhas ser concluída contamos com o apoio de algumas empresas, entre elas: SPA Serra Negra ( o que é massoterapia ), Prospen ( consulta CPF grátis ), Viga ( silos metálicos ) e eSites ( criar site de vendas grátis ).