Diferença entre Pilhas e Eletrólise
A principal diferença entre a pilha e eletrólise é que essa representa uma reação espontânea que conduz corente elétrica, já a segunda representa uma reação química não espontânea, que, por isso, consome corrente elétrica. Tanto na pilha quanto na eletrólise, o cátodo reduz o nox dos elementos com os quais interage e o ânodo os aumenta. Todavia, se, na pilha, o ânodo exerce o polo negativo e o cátodo o positivo, na eletrólise é o contrário, o polo negativo será o cátodo e o positivo será o ânodo.
Tudo sobre eletrólise
No caso da eletrólise, por conseguinte, é necessário que se utilize um gerador elétrico para manter a corrente elétrica ativa e, consequentemente, alimentar a reação química do processo de redução e oxidação da eletrólise, muito utilizada na obtenção do alumínio por meio da alumina, obtida no processamento da bauxita. É importante considerar que a corrente elétrica na eletrólise deve ser, obrigatoriamente, uma corrente contínua, pois a corrente elétrica alternada não possui a capacidade de causar a eletrólise.
Eletrólises, assim como as pilhas, podem ocorrer na presença de compostos iônicos fundidos, também chamados de “compostos em seu estado líquido”, ou de soluções aquosas, expressas por ácidos, bases ou sais. Essas soluções podem consumir ou gerar corrente elétricas pois elas possibilitam o transito de eletrólitos quando em estado líquido.
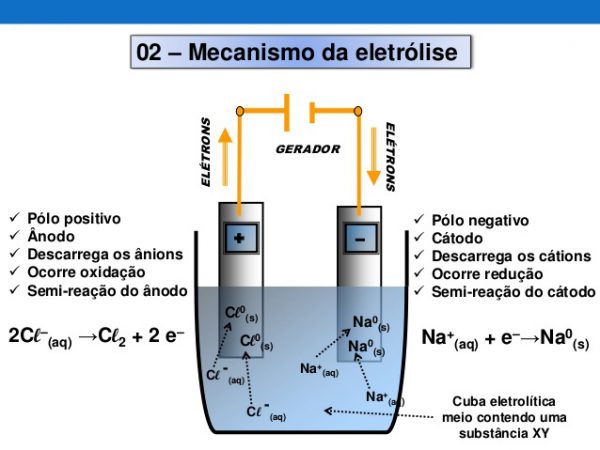
Cuba eletrolítica
A representação gráfica do gerador, utilizado na eletrólise, é expressado tendo a parte maior como sendo a positiva, e a parte com o lado, perpendicular ao fio, menor, como o polo negativo, sendo o eletrodo, basicamente, então, uma extensão do gerador, que possui, na eletrólise, o cátodo como o polo negativo, e, o ânodo como o polo positivo.
O cátodo, sendo, na eletrólise, o polo negativo, atrairá cátios, que são positivos. O ânodo, por ser positivo, atrairá ânions, que são negativos e terão seu nóx aumentado. Por isso, diz-se que o cátodo reduzirá os elementos positivos que atrai e o ânodo oxidará os elementos negativos que vêm a ele.
Nesta imagem, da cuba eletrolítica, vemos uma eletrólise. Sabemos que o processo em destaque é uma eletrólise, porque no caso da pilha, que representaria uma reação espontânea, é o oxigênio que seria reduzido no cátodo, e não o sódio (Na), como é mostrado na figura. Normalmente, no caso da pilha, diz-se célula eletroquímica, ao invés de cuba ou célula eletrolítica.
Eletrólise aquosa
A eletrólise aquosa acontece quando os eletrólitos presentes na reação estão em sais, ácidos ou bases, diferentemente da eletrólise ígnea, na qual os elétrons transitam em compostos iônicos fundidos, demandando ainda mais energia.
Numa solução aquosa, a água pode competir pelo eletrodo (cátodo ou ânodo), por isso, para saber exatamente qual elemento se oxidará ou reduzirá, é importante saber o potencial de redução de cada um. Entretanto, há um pequeno macete para lembrá-lo de forma mais dinâmica sobre a prioridade de descarga dos átomos ou compostos, geralmente, envolvidos na eletrólise aquosa. No caso dos cátios, dos das famílias 1A e 2A ou o Al3+, possuem menor tendência a redução, já os demais metais, a partir do H+, são mais propensos a se reduzirem. Já no caso dos ânions, os oxigenados e o fluoreto apresentam baixa prioridade de oxidação, como o SO42-, o NO3– e o F–, tendo, a partir do OH–, os demais ânions uma maior prioridade de oxidação.

Portanto, com esse conhecimento já em mãos, agora é fácil saber quem irá oxidar ou reduzir na eletrólise aquosa do NaCl, pois, sendo o Na+ da família 1A, ele apresenta menor potencial de redução que o H+, e o Cl– maior potencial de oxidação que o OH–. Dessa maneira tem-se:
NaCl -> Na+(aq) + Cl–(aq)
H2O -> H+(aq) + OH–(aq)
Reação de redução no cátodo (-): 2H+ (aq) + 2e– -> H2(g)
Reação de oxidação no ânodo (+): 2Cl–(aq) -> Cl20(g)+ 2e–
Reação global da eletrólise do NaCl em meio aquoso: 2H+(aq) + 2Cl–(aq) -> H2(g) + Cl20(g)
Como o Na+ e o OH– sobraram na reação, eles formarão uma terceira substância, o NaOH, de nome hidróxido de sódio ou soda cáustica. Portanto, ao final da eletrólise da salmoura, há três produtos, gás hidrogénio formado no cátodo, gás cloro formado no ânodo e hidróxido de sódio, ousoda cáustica, formada na cuba eletrolítica.
Eletrólise ígnea
A eletrólise ignea ocorre num processo com ausência total de água. Por isso, processos de eletrólise ígneas são, normalmente, sofridos por compostos iônicos no seu estado fundido, demandando, então, muita energia, pois para se fundir um composto iônico, como o NaCl, é necessário que este alcance 801ºC, por exemplo.
Tomando como exemplo, para o processo de eletrólise, o NaCl fundido. Este teria o Na+ como cátion e o Cl– como ânodo, sendo atraídos, respectivamente, pelo cátodo e pelo ânodo. Já que na eletrólise o cátodo se expressa pelo polo negativo, que atrai elementos positivamente carregados, e o ânodo se idendifica como o polo positivo, que atrai elementos negativamente carregados.
Reações da eletrólise ígnea de NaCl
Reação de redução: 2Na+ + 2e– -> 2Na0
Reação de oxidação: 2Cl– -> Cl02 + 2e–
Reação global da pilha: 2Na+ + 2Cl– -> 2Na0 + Cl2
Eletroquímica: Pilhas eletrolíticas
Quando se fala em eletroquímica, pensa-se em tranferência de elétrons, por meio de reações químicas, que no caso da pilha, diferentemente da eletrólise, são espontâneas. Quando um elemento recebe elétron, diz-se que ele reduziu, pois teve seu nox diminuído, quando esse doa elétrons, diz-se que ele oxidou, pois teve seu nox aumentado. Na pilha, o ânodo e o cátodo, oxidam e reduzem, respectivamente, assim como na eletrólise. Contudo, nesta, os eletrodos apresentam sinais contrários, se na pilha o ânodo é negativo e o cátodo positivo, na eletrólise eles são positivos e negativos, respectivamente. Os elétrons, como apresentam carga negativa, “caminham” em direção do ânodo ao cátodo, na pilha, sendo este trajeto, o contrário na eletrólise.
Uma pilha bastante comum de se estudar é a da reação entre o CuSO4 e o zinco. Nesta, pelo fato de o zinco possuir menor potencial de redução, ele irá oxidar, tendo seu nox aumentando de zero para dois. Já o Cu, terá seu nox reduzido, pois possui grande potencial de redução, indo de dois a zero, como está representada na fórmula a seguir:
Reação de oxiredução: CuSO4(aq) + Zn0(s) -> Cu0(s) + ZnSO4(aq)
Na reação acima, o Cu teve seu nox reduzido, passando de dois para zero, e o zinco, aumentado, passando de zero a dois.
Reação global desta pilha eletrolítica: Cu(aq) + Zn0(s) -> Cu0(s) + Zn2+(aq)
Pilha de Daniell
A Pilha de Daniell, como é conhecido o modelo de pilha estudado no segundo grau é muito simples e pode ser feito utilizando apenas água, sal, alumínio e cobre. Mas há quem diga que se colocar um pouco de água sanitária na Pilha de Daniell ela pode ficar um pouco mais poderosa, confira o a aula de eletroquímica em destaque.
O que é ponte salina
Devido ao fato de que o SO4 ser considerado, na equação acima, apenas um íon espectador, podemos considerar a reação em destaque, sem ele, como a reação global desta pilha eletrolítica. O íon espectador, apesar de não compor os produtos, é muito importante no quesito concentração, pois é ela que garante a continuidade do funcionamento, ou não, da pilha, tendo, esta, o fim de sua vida útil quando a concentração do íon espectador é igual nos dois lados da célula eletrolítica. Quando isso acontece, sabe-se que a oxidação, ou corrosão, do eletrodo negativo, no caso da pilha, do ânodo, é a máxima possível e, consequentemente, o cátodo é o mais inchado possível, não suportando, no esquema em questão, maior depósito de cátions.
Como calcular a DDP da pilha e a reação global da pilha
O que é eletrodo?
Eletrodos, em reações químicas do segundo grau, geralmente, são formados por platina ou carbono. No caso da platina, na realidade, o eletrodo seria composto por hidrogênio, já que esse é capaz de se revestir deste gás. Deste modo, diz-se que a platina é um eletrodo inerte, pois ele não reage com os componentes em questão, apenas o hidrogênio, diferentemente do que ocorre na produção de alumínio, no qual o carbono do eletrodo, por reagir com o oxigênio, descaracteriza uma eletrólise com eletrodos inertes.
Eletrodo de carbono
Muita gente se admira ao escutar que o carbono é utilizado em reações químicas para a produção de energia, pois esse elemento é tido, por ser um ametal, como um mal condutor de energia no conceito popular. Entretanto, como o carbono pode se apresentar em diversas formas, numa destas ele se mostra interligado por uma estrutura em camadas, como é o caso do grafite. Essa estrutura não metálica, apesar de, a olho nú, nos parecer estática, na verdade, permite, muito bem, o transito de elétrons, característica que também justifica o uso do grafite como lubrificante.
Exemplo da pilha de zinco e hidrogênio
Eletrodo padrão de hidrogênio em uso
Neste caso, por possuir menor potencial de redução que o ácido sulfúrico, o zinco sofreria oxidação no anodo, que, por constituir uma pilha, seria o polo negativo desta.
Oxidação do zinco: Zn0(s) -> Zn2+(aq) + 2e–
Redução do hidrogênio: 2H1+(aq) + 2e– -> H02(g)
Reação global da pilha de zinco: Zn0(s) + 2H1+(aq) -> Zn2+(aq) + H02(g)
Dependendo do metal utilizado numa pilha de hidrogênio, este pode funcionar como polo negativo ou polo positivo, tudo irá depender se o outro metal utilizado na fabricação da pilha tenha um potencial de redução maior ou menor do que o do hidrogênio. No caso da pilha de zinco, como o potencial de redução deste é de -0,76 V, menor do que o do hidrogênio, que é praticamente igual a 0 V, ele acabou por oxidar. Contudo, há metais, como os que compõem o grupo dos metais nobres, que possuem potencial de redução maior que zero, causando a oxidação do hidrogênio na pilha.
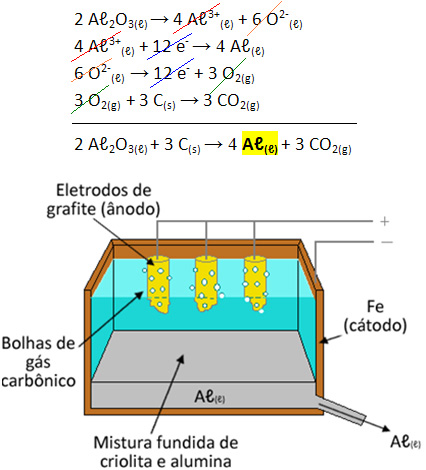
Eletrólise do alumínio
A eletrólise tem caído consideravelmente em provas do ENEM relacionada à produção de alumínio. Neste caso, o alumínio será produzido a partir da alumina por meio do processo de eletrólise. Neste, o átomo de alumínio é reduzido pelo cátodo e o oxigênio, presente na alumina, é desprendido do átomo de alumínio por meio da sua oxidação, resultando em gás carbônico devido ao átomo de carbono do eletrodo ao qual se junta no ânodo.
O que são eletrodos inertes?
Vale ressaltar que, em casos clássicos de eletrólises, geralmente estudadas no ensino médio, os eletrodos são chamados de eletrodos inertes, pois não reagirão com os componentes. Deste modo, a reação ocorreria sobre os eletrodos, mas eles mesmo não reagiriam. Contudo, não é o que acontece no caso da produção de alumínio, que tem o oxigênio fundido ao carbono vindo do eletrodo que se oxida, formando o CO2.
Reação de obtenção do alumínio da fábrica
Patrocinadores dessa aula sobre eletrólise e pilha de Daniell
Para essa aula sobre eletrólise e pilha de Daniell ser concluída contamos com o apoio de algumas empresas, entre elas: Mudas Delivery ( mudas de banana ), Prospen ( consulta CPF grátis ), Viga ( silos metálicos ) e eSites ( criar site de vendas grátis ).
